Olores y sabores químicos
Existe un grupo de sustancias muy difundidas en la naturaleza que posee
un gran valor biológico e industrial. Se trata de los ácidos carboxílicos y sus derivados.
Estos ácidos son los que nos permiten apreciar la sensación agridulce
cuando tomamos una limonada, el sabor especial de la vinagreta en una ensalada,
o los agradables olores de las frutas frescas.
Algunos de los ácidos que dan el sabor a los alimentos y a las
sustancias son:
- El ácido acético que es el componente
principal del vinagre, aderezo empleado en la cocina.
- El ácido cítrico que es el que da el
sabor agridulce a las frutas que pertenecen a la familia de los cítricos y es un
producto intermedio en el metabolismo de los carbohidratos. Se emplea
comercialmente en grandes cantidades, como acidificante en la fabricación de
bebidas gaseosas.
- El ácido acetilsalicílico que se emplea
en la fabricación de la aspirina, analgésico muy popular.
Asimismo, existen sustancias orgánicas llamadas esteres, que producen olores diversos.
Son derivados de los ácidos carboxílicos.
Algunos de los esteres que producen el olor de los alimentos
son:
- El acetato de amilo que se encuentra en
el plátano.
- El butanoato de amilo que se encuentra en
el albaricoque.
- El acetato de etilo que
se encuentra en la piña.
Estructura del grupo carboxilo
Los ácidos carboxílicos provienen de la oxidación de los aldehídos. Su grupo funcional se denomina carboxilo (—COOH), conformado por un grupo carbonilo y un grupo hidroxilo. Esta combinación es tan íntima, que ninguno de los dos grupos actúa ni física ni químicamente de manera independiente. El grupo carboxilo es ácido debido a su capacidad para donar protones. En el agua, la mayoría de los ácidos carboxílicos se encuentran ligeramente disociados:
Clasificación
La clasificación de los ácidos carboxílicos puede hacerse teniendo en
cuenta dos aspectos:
· El número de grupos carboxilo que contiene la molécula del ácido.
De acuerdo
con esto los podemos clasificar en:
o Monocarboxílicos: cada molécula contiene
tan solo un grupo carboxilo. Su fórmula general es R—COOH. Ejemplo:
CH3—COOH
o Dicarboxílicos: cada molécula contiene
dos grupos carboxilo. Su fórmula general es
HOOC─(CH2)n─COOH. Ejemplo: HOOC─COOH
o
· La naturaleza de la cadena carbonada unida al grupo funcional.
De acuerdo
con esto los podemos clasificar en:
o Ácidos carboxílicos de la serie alifática. Tienen como fórmula
general —R—COOH. Ejemplo:
Ácido benzoico
Puede presentarse otra serie de variables dentro de la estructura de los
ácidos carboxílicos, como la presencia de dobles enlaces, grupos hidroxilo,
etc., que de alguna manera intervienen en las propiedades, tanto físicas como
químicas, de los mismos.
Nomenclatura
Los ácidos carboxílicos, de acuerdo con las normas de la IUPAC , se nombran
anteponiendo la palabra ácido al nombre del alcano correspondiente y cambiando
la terminación "o" de éste por "oico".
La cadena más larga es aquella que contenga el grupo carboxilo y a su
carbono se le designa con el número (1), luego se numeran los sustituyentes
unidos a la cadena principal de la forma como se hace
normalmente.
También se acostumbra emplear nombres comunes o vulgares para denominar
a los ácidos carboxílicos. Algunos ejemplos se aprecian a
continuación:
Propiedades físicas. Constante de acidez
El comportamiento químico y físico de los ácidos carboxílicos, depende
principalmente de la distribución electrónica de carga sobre los átomos
adyacentes al grupo funcional. Los ácidos orgánicos, como los alcoholes,
presentan puntos de ebullición relativamente altos en relación con su peso
molecular, a causa de los enlaces de hidrógeno. Cuando están en estado líquido,
tienden a formar díme-ros y polímeros empleando los puentes de hidrógeno
intermoleculares.
Sin embargo, los ácidos forman enlaces de hidrógeno más fuertes que los
alcoholes, debido a que sus enlaces (O
H) se encuentran fuertemente polarizados. Además, los ácidos carboxílicos
tienen la posibilidad de formar enlaces de hidrógeno con el oxígeno más negativo
del dipolo carbonílico, en vez de hacerlo con el oxígeno del grupo
hidroxilo.
· Estado físico. Los primeros términos,
hasta nueve átomos de carbono son líquidos. Los términos medios son de
consistencia aceitosa y los términos superiores son sólidos cristalinos. El
ácido metanoico, el ácido etanoico y, en general, los primeros miembros de la
serie, tienen olor irritante. En los términos medios, el olor es rancio y
repugnante y los términos superiores por lo general, no presentan ningún
olor.
· Solubilidad. El ácido metanoico, el
ácido etanoico y el ácido propanoico, son solubles en agua; esto se debe a los
enlaces de hidrógeno. De ahí en adelante la solubilidad decrece a medida que
aumenta el peso molecular. Sin embargo, los ácidos que son insolubles en agua
son solubles en alcohol, éter, benceno y cloroformo.
· Constante de acidez. La principal
característica del grupo carboxilo es su acidez. En general, los ácidos
carboxílicos son ácidos débiles debido a la tendencia del enlace (RCOO—H) a
romperse heterolíticamente en presencia de una base (aceptora de protones), tal
como puede apreciarse en la siguiente ionización.
La acidez de los ácidos carboxílicos se atribuye a que el ion
carboxilato se puede estabilizar como híbrido de resonancia con la carga
negativa distribuida sobre un sistema conformado por tres
átomos.
Propiedades químicas de ácidos carboxílicos
Reacciones producidas por el rompimiento del enlace (O─H)
· Formación de sales:
Un primer grupo de estas reacciones se debe al rompimiento del enlace
oxígeno-hidrógeno (O─H). Este rompimiento se produce gracias al carácter
débilmente ácido del átomo de hidrógeno de este enlace, lo que permite que la
molécula lo libere en forma de protón. Tal como ocurre con los ácidos
inorgánicos, los ácidos carboxílicos reaccionan con las bases para formar
sales:
Reacciones producidas por el rompimiento del enlace (─C─OH)
Un buen número de reacciones de los ácidos carboxílicos, se realizan
mediante un ataque sobre el carbono carbonilo por parte de especies
nucleofílicas. Estas reacciones son por lo general catalizadas por ácidos,
puesto que la adición de un protón o la formación de un enlace de hidrógeno
sobre el oxígeno carbonílico, hace al carbono del carbonilo más electropositivo
y, por tanto, más vulnerable al ataque nucleofílico. Observemos el proceso a
través de las siguientes reacciones:
El rompimiento subsiguiente del enlace C -£ O y ¡a pérdida de un protón,
conducen al producto del desplazamiento.
Un ejemplo evidente de esta reacción se observa en la formación de
esteres.
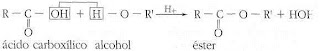
· Formación de esteres
Los esteres se forman por reacción de un ácido carboxílico con un
alcohol, en presencia de un ácido.
· Formación de cloruros de ácido
Los ácidos carboxílicos reemplazan el (OH) por un átomo de cloro cuando
reaccionan con tricloruro de fósforo, pentacloruro de fósforo o cloruro de
tionilo.
· Descarboxilación de
los ácidos
carboxílicos
La facilidad con que el grupo carboxilo pierde dióxido de carbono, varía
mucho con la naturaleza del ácido. Algunos pierden dióxido de carbono
simplemente al ser calentados a temperaturas moderadas.
La descarboxilación térmica se efectúa muy fácilmente cuando el carbono
lleva un grupo que atraiga electrones (es decir, un sustituyente que produce un
efecto inductivo negativo). Estos son algunos ejemplos:
Derivados de los ácidos carboxílicos
Esteres
Los esteres resultan de la reacción entre un ácido orgánico o inorgánico
sobre un alcohol, con eliminación de una molécula de agua. Es una reacción
reversible, la cual, mediante la hidrólisis, regenera el ácido y el alcohol. La
reacción se puede representar así:
Los esteres están ampliamente repartidos, en la naturaleza en sustancias
de origen vegetal o animal.
· Clasificación. Los esteres pueden ser
clasificados en tres grupos:
o Esencias de frutas: están formadas por
ácidos carboxílicos de bajo peso molecular y por algunos ácidos carboxílicos de
mediano peso molecular, cuando reaccionan con alcoholes también de bajo peso
molecular.
o Grasas (lípidos): son esteres de la
glicerina con ácidos grasos superiores y medios.
o Ceras: formadas por ácidos carboxílicos y alcoholes de elevado peso
molecular.
· Propiedades. Los esteres neutros son
líquidos, incoloros, de olor agradable, como de frutas maduras. Son volátiles,
insolubles en agua, solubles en alcohol y éter. Los términos superiores son
sólidos y de consistencia oleosa y aspecto céreo o grasoso.
Los esteres son sustancias dotadas de una gran reactividad química. En
la mayor parte de las reacciones la molécula se rompe:
Una de las reacciones más importantes es la saponificación. La saponificación de
un éster consiste en tratarlo con una base alcalina (NaOH o KOH) hasta
ebullición. La reacción general es:
La reacción es completa y debe su nombre al hecho de ser utilizada en la
fabricación de jabones.
· Usos y aplicaciones. Comercialmente sólo
unos pocos esteres tienen importancia. Los dos más usados son el acetato de
etilo y el acetato de butilo.
Son usados como disolventes para nitrocelulosa y en la fabricación de
lacas. Algunos de elevado peso molecular son empleados como plastificantes,
mientras que otros se emplean en la fabricación de plásticos. Los esteres
sintéticos son usados como aromatizadores de alimentos. Los más conocidos son:
Acetato de amilo (plátano), Acetato de octilo (naranja), Butirato de etilo
(pina), Butirato de amilo (albaricoque), Formiato de isobutilo (frambuesa) y
Formiato de etilo (ron).
En medicina suelen ser usados los esteres como agentes terapéuticos. Por
ejemplo, el acetato de etilo es estimulante y antiespasmódico en irritaciones
cólicas y bronquiales. En aplicación externa se emplea para el tratamiento de
enfermedades dermatológicas causadas por parásitos. La nitroglicerina actúa como
un vasodilatador. Con el ácido acético se forma uno de los esteres más
importantes del ácido salicílico, la aspirina o ácido
acetilsalicílico.
Amidas
Cuando los ácidos carboxílicos reaccionan con amoníaco, producen sales
de amonio que por calentamiento forman amidas, cuya fórmula general es (R—CONH2).
Las amidas se forman por rompimiento del enlace (—C—OH) del ácido
carboxílico.
Las amidas se nombran a partir del nombre del hidrocarburo del que se
derivan, añadiendo el sufijo amida.
Ejemplos:
2.1.Propiedades físicas
La formamida es
líquida, las demás son sólidos cristalinos. Sus puntos de ebullición son más
altos que los de los ácidos correspondientes. Los primeros términos son solubles
en agua, pero la solubilidad decrece a medida que aumenta el peso molecular.
Poseen carácter anfótero, esto
quiere decir que se comportan como bases o ácidos débiles, según el medio de
reacción.
2.2.
Métodos de preparación
· Se pueden preparar por
deshidratación de las sales de amonio. Las sales de amonio (R—COONH4)
de los ácidos carboxílicos, calentadas a 200ºC ,
pierden una molécula de agua dando como resultado las
amidas.
· Un método general para
preparar las amidas consiste en hacer reaccionar el amoníaco sobre los cloruros
de ácido.
El método es bueno,
especialmente para las amidas poco solubles, y se realiza dejando caer
lentamente el cloruro en la solución concentrada de amoníaco bien frío. La amida
cristaliza inmediatamente.
2.3.Aplicaciones
La amida más importante es la urea, H2N—C—NH2;
es una diamida proveniente del ácido carbónico. Se encuentra en los organismos
vivos. Fue sintetizada por Wöhler en 1828 y sirvió como principio para el
desarrollo de la química orgánica. Uno de los usos industriales es la producción
de sedantes, conocidos con el nombre de barbitúricos. También se le emplea como
fertilizante, en la industria de plásticos con metanal y aserrín de madera, como
diurético y contra la gota y el reumatismo.
Anhídridos
Los anhídridos son sustancias orgánicas
que provienen de la deshidratación de dos moléculas de ácido orgánico. Se
nombran anteponiendo la palabra anhídrido al nombre del ácido del cual
provienen.
2.4.Propiedades
Los primeros términos son líquidos, de olor picante y sofocante; los
términos superiores son sólidos e inodoros, poco solubles en agua pero al mismo
tiempo reaccionan con ella para regenerar los ácidos correspondientes. Presentan
puntos de ebullición más altos que los de los ácidos
correspondientes.
2.5.Preparación
El procedimiento más empleado consiste en la reacción entre un cloruro
de ácido y una sal alcalina. La reacción general es:
2.6.Aplicaciones
Los anhídridos se emplean como agentes de acilación en la preparación de
esteres a partir de los alcoholes. También se usan como deshidratantes. Resultan
demasiado cáusticos para ser utilizados en medicina.
Usos de los ácidos carboxílicos
· Acido fórmico o metanoico. Se encuentra en algunos
insectos, como las hormigas, a quienes debe su nombre; en las abejas, en la
trementina, etc. Se emplea en la síntesis de esteres, sales, plásticos y ácido
oxálico. También se usa como mordiente para tejidos de lana o de algodón en
lugar del ácido acético o del sulfúrico.
· Acido acético. Es el principal
componente del vinagre. Puede ser producido por la fermentación de zumos de
frutas como la uva, manzana, etc. Diluido del 5 al 10% se emplea como
condimento. También se utiliza en la preparación de algunos colorantes, como
disolvente de esencias, en la fabricación de goma adhesiva (mezclado con
colapiscis), como detenedor en fotografía, en la obtención de acetato de
celulosa y como antídoto (medicina) contra los álcalis en solución al
6%.
· Acido oxálico o etanodioico. Es uno de los ácidos orgánicos más fuertes. Se encuentra en las hojas del
ruibarbo y de col, en los garbanzos y en las acederas en forma de oxalato ácido
de potasio; en los líquenes, mohos, helechos y algas en forma de oxalato de
calcio cristalizado. Es empleado en las lavanderías para quitar las manchas de
tinta y de hierro y en la fabricación de tintas y de colorantes; para blanquear
el cuero y el mimbre.
· Acido acetilsalicílico. Es un excelente
analgésico y un poderoso antiséptico del intestino, donde probablemente se
descompone dejando libre el ácido salicílico. No se modifica en el estómago. Se
usa también contra el reumatismo y contra la gota.
· Acido cítrico. Se puede considerar
como uno de los ácidos más abundantes en la naturaleza. Se encuentra
especialmente en las frutas del género citrus, en la remolacha, en las cerezas y
en las cebollas. Se obtiene en grandes cantidades por un proceso de fermentación
del almidón o de las melazas. Es empleado para dar sabor ácido a productos
alimenticios y bebidas refrescantes. Los citratos alcalinos se usan en la
preparación de productos farmacéuticos contra la gota y el reumatismo. También
se usa como laxante y anticoagulante.











Muchas gracias que buen blog
ResponderEliminarbuen blog bastante completo
ResponderEliminarMuy buen contenido. Gracias!
ResponderEliminar